Строение и свойства сплавов, поведение при различных технологических процессах и в условиях эксплуатации определяются их химическим составом, т. е. содержанием заданных компонентов и примесей. Закономерности изменения свойств тесно связаны с типом диаграммы состояния и ее особенностями для каждой системы сплавов. Для выбора состава сплава и конкретного суждения о его свойствах наряду с диаграммой состояния необходимо иметь зависимость свойств (электросопротивления, т. э. д. с. твердости, прочности, пластичности, теплового расширения и др.) от состава. Для ряда систем диаграммы состояния совмещены с зависимостью свойств от состава и называются диаграммами физико-химического состояния.
Выбор сплавов, содержащих благородные металлы, во многом определяется их высокой стоимостью и дефицитностью. Наиболее рационально применять благородные металлы и их сплавы для ответственных деталей приборов и других изделий, если требуются особые свойства (или их совокупность), которых не имеют черные и цветные металлы и сплавы и неметаллические материалы. К числу особых свойств относятся: постоянство удельного электросопротивления, стабильность изменения т. э. д. е., магнитожесткость и др.
Характеристика систем сплавов, содержащих благородные металлы
Двойные системы сплавов
Серебро — легирующий компонент
Серебро—барий. Барий так же, как кальций и стронций, нерастворим в серебре и образует с ним химические соединения ВаАg5, Ва2Ag3 и др.
Серебро—бериллий.
Серебро—бор. Бор не растворяется в жидком (до температуры 1500— 1600°С в токе воздуха) и твердом серебре.
Серебро—ванадий. Взаимно нерастворимы в жидком (до 1800° С) и твердом состояниях.
Серебро—висмут. Растворимость висмута в серебре при 900°С равна 0,5 ат. % (1,0 вес. %), при 800°С 1,2 ат. % (2,3 вес. %), при 700°С 1,9 ат. % (3,6 вес. %), при 600°С 2,6 ат. % (5,05 вес. %), при 500°С 2,6 ат. % (4,95 вес. %), при 400° С 2,0 ат. % (3,85 вес. %), при 300°С 1,2 ат. % (2,4 вес. %), при 266°С 0,9 ат. % (1,75 вес. %), при 226°С 0,4 ат. % (0,85 вес. %), при 200°С 0,33 ат. % (0,6 вес. %) висмута.
Серебро — водород. Растворимость водорода в серебре при 600°С равна 0,019 см3, при 700°С 0,025 см3, при 800°С, 0,036 см3, при 900°С 0,046 см3 водорода при 1 см3 серебра.
Серебро—вольфрам. Взаимно не растворимы в жидком и твердом состояниях.
Серебро—галлий. Растворимость галлия в серебре при 611°С (а + Ж ↔ β) составляет 18,7 вес. % (13 ат %), при 380°С (β ↔γ ) 17,6 вес. % (12,2 ат. %), при 200°С 11,8 вес. % (8,0 ат. %) Ga. Растворимость серебра в галлии при 25°С (Ж↔Gа + δ) равна 3 ат. % (4,5 вес. %) серебра.
Серебро—германий. Образуют эвтектику при температуре 651°С и содержании 25,9 ат. % (19 вес. %) Gе. Растворимость германия в серебре при температуре 651°С равна 9,6 ат. % (6,7 вес. %) и при 250° С 1,5 ат. % (1,0 вес. %) Gе. Серебро в германии в твердом состоянии не растворимо.
Серебро—золото. Неограниченно взаимно растворимы в жидком и твердом состояниях. Сплавы золота с серебром имеют высокую пластичность при холодной и горячей деформации во всем интервале концентраций.
Абсолютная т. э. д. с. сплавов золота с серебром ε, мкв/°С
| Ag aт. % |
Температура, °С | |||||||||
| 0 | 100 | 200 | 300 | 400 | 500 | 600 | 700 | 800 | 900 | |
| 10 20 30 40 50 60 70 80 90 |
0,02 —0,88 —1,00 —1,14 —1,50 —1,84 —1,60 —1,60 —1,14 |
0,23 —0,74 —1,00 —1,20 —1,56 —1,84 —1,60 —1,59 — 1,08 |
0,44 —0,60 —1,00 —1,26 —1,62 —1,84 —1,60 —1,58 —1,00 |
0,65 —0,46 — 1,00 —1,31 —1,68 —1,84 —1,60 — 1,57 —0,89 |
0,87 —0,32 —1,00 —1,36 -1,74 —1,84 —1,60 —1,52 —0,68 |
1,08 —0,18 —1,00 —1,42 —1,81 —1,84 —1,60 —1,40 —0,20 |
1,29 —0,05 —1,00 —1,48 —1,87 —1,84 —1,60 — 1,20 +0,70 |
1,50 +0,09 —1,00 —1,53 —1,94 — 1,84 —1,60 —0,98 + 1,60 |
1,71 +0,23 —1,00 —1,59 —2,00 —1,84 —1,60 —0,67 +2,50 |
1,92 —0,36 —1,00 —1,65 —2,06 —1,84 -1,60 —0,35 +3,4 |
Серебро—иридий. Иридий нерастворим в серебре.
Серебро—кислород. Кислород растворим в жидком и твердом серебре. Растворимость при 200° С равна 1,3 см3, при 300° С 0,924 см3, при 400° С 0,828 см3, при 500° С 0,905 см3, при 600° С 1,26 см3, при 700° С 1,84 см3, при 800° С 3,37 см3, при 923° С 5,43 см3, при 973° С 213,5 см3, при 1024° С 205 см3, при 1075° С 193,9 см3, при 1125° С 184,9 см3 кислорода на 100 г серебра при атмосферном давлении.
Серебро—кобальт. Серебро и кобальт практически взаимно нерастворимы как в жидком, так и в твердом состояниях. Растворимость кобальта в серебре составляет 4—10•10-4 вес. % (при кристаллизации).
Серебро — кремний. Примесь кремния ухудшает обрабатываемость давлением серебра и его сплавов.
Серебро — медь. Растворимость меди в серебре при 779° С (температура эвтектики) равна 8,8 вес. %, при 750° С 7,5 вес. %, при 700° С 5,8 вес. %, при 600° С 3,3 вес. %, при 500° С 1.8 вес. %, при 400° С 0,9 вес. %, при 300°С 0,4 вес. %, при 200° С 0,3 вес. %, при 100° С 0,2 а 0—0,1 вес. % меди. Растворимость серебра в меди при 779° С равна 8,0 вес %, при 700° С 5,2 вес. %, при 600° С 2,6 вес. %, при 500° С 1,3 вес. %, при 400° С 0,5 вес. %, при 300° С 0,2 вес. %, при 200° С 0,06 вес. % серебра.
Сплавы серебра с медью при кристаллизации склонны к ликвации. Ликвация значительно усиливается при введении никеля (многокомпонентные серебряные припои). Введение в серебро меди способствует окислению сплава при нагревании как с поверхности, так и во внутренних слоях за счет диффузии кислорода. Внутреннее окисление при последовательном нагревании сплава в атмосферах, содержащих кислород, а затем водород, ведет к замедлению роста зерна, водородной болезни и появлению пузырей. Образую¬щиеся в результате окисления при плавке или термической обработке в атмосфере, содержащей кислород, окислы меди резко снижают пластичность сплавов как в холодном, так и в нагретом состояниях, вызывая хладноломкость и красноломкость.
Во избежание этих явлений применяют раскислители и не допускают последовательной обработки в окислительной, затем в восстановительной атмосфере. В качестве раскислителя обычно применяют фосфористую медь. Избыток фосфора нежелателен, так как ведет к образованию хрупких фосфидов серебра и окислов меди. Пленка, образующаяся на поверхности при нагревании, состоит в основном из окислов меди Сu20 и СuО. Соотношение между ними определяется температурой нагрева и составом атмосферы. При недостаточном количестве кислорода (слабоокислительная атмосфера) на поверхности образуется пленка Сu20 (красного цвета), трудно удаляемая при обычном отбеле в разбавленной серной кислоте. При нагревании в окислительной атмосфере и последующем отбеле (особенно многократных) поверхность сплава обогащается серебром. Последнее используют в ряде случаев, в частности при эмалировании прозрачными эмалями. Примеси висмута, свинца и сурьмы в сплавах строго ограничиваются, так как вредно отражаются на обрабатываемости сплавов, вследствие содержания в них меди.
Серебро и сплавы серебра с медью легко паяются (серебряными припоями) свариваются, полируются, давая возможность получения изделий всевозможной формы с сильным блеском (большой отражательной способностью).
Серебро—молибден. В жидком серебре молибден имеет ограниченную растворимость — при 1600° С не менее 5,6 ат. % (5 вес. %) Мо. В твердом состоянии серебро практически не растворяет молибден.
Серебро—мышьяк. Растворимость в серебре при 595° С равна 8,3—8,8 ат. % (5,9—6,3 вес. %), при 545°С 8,0—8,5 ат. % (5,7—6,1 вес. %), при 500° С 7,9 ат. % (5,6 вес. %), при 400° С 5,2 ат. % (3,7 вес. %), при 300° С 4,3 ат. % (3,0 вес. %) мышьяка. Серебро в мышьяке практически нерастворимо.
Серебро—натрий. Серебро с натрием образуют эвтектику при 97° С. Взаимная растворимость незначительна.
Серебро — никель. Серебро с никелем ограниченно растворимы друг в друге в жидком состоянии. Монотектическая температура равна 1435° С. Растворимость никеля в серебре имеет следующую зависимость от температуры: Температура, °С 922 860 785 702 640 600 510 400
Растворимость NI, вес. % 0,102 0,084 0,066 0,044 0,032 0,026 0,018 0,012
Предполагают, что серебро также незначительно растворимо в никеле.
Серебро — олово. При плавке серебра и его сплавов, содержащих примеси олова, образуется нерастворимая в металле твердая окись олова SnO2, ухудшающая качество полуфабрикатов и изделий.
Серебро — палладий. Серебро и палладий образуют после кристаллизации непрерывный ряд твердых растворов.
Серебро — рений. Рений нерастворим в жидком и твердом серебре.
Серебро — родий. Нерастворимы в жидком состоянии в пределах от 25 до 99,5 вес. % Растворимость серебра в родии в твердом состоянии при 100° С примерно 5 вес. % и при 1400 С около 10 вес. % Ag. Растворимость родия в серебре незначительна.
Серебро — ртуть. Растворимость ртути в серебре при 276° С равна 37,3 ат. % (52,4 вес. %), при 200° С 36,7 ат. % (51,8 вес. %) и при 100° С 36,5 ат. % (51 вес. %) Hg. При 45° С она возрастает до 37,1 ат. % Hg. Растворимость серебра в ртути при 20° С равна 0,035 ат. % (0,066 вес. %), при 50° С 0,08 ат. % (0,145 вес. %), при 100° С 0,23 ат. % (0,41 вес. %), при 150° С 0,48 ат. % (0,92 вес. %) и при 200°С 0,93 ат. % (1,17 вес. %) Ag.
Серебро — рутений. В жидком состоянии имеют разрыв растворимости. В жидком серебре растворяется примерно 3% Ru. В твердом рутений практически нерастворим в серебре.
Серебро — свинец. Растворимость свинца в серебре имеет следующую зависимость ет температуры:
Температура, °С 900 800 700 600 500 400 300 280 250
Растворимость:
ат. % 1,1 2,1 2,6 2,8 2,1 1,5 0,75 0,6 0,350
вес. % 2,0 3,95 4,9 5,2 3,95 2,8 1,4 1,1 0,65
В свинце растворимость серебра составляет при 304° С 0,19 ат. % (0,10 вес. %), при 200° С 0,095 ат. % (0,05 вес. %) и при 100° С 0,04 ат. % (0,02 вес. %) Аg.
Серебро — селен. Серебро и селен образуют химическое соединение Аg2Se с температурой плавления 987° С. В системе Ag — Аg2Se растворимость в жидком серебре при монотектической температуре (около 890° С) равна 12 ат. % (9 вес. %) Se. Ag +β -Аg2Se образуют эвтектику (840° С).
При температуре 122° С β -Аg2Se переходит в α -Аg2Se. Как α-, так и β- Аg2Se нерастворимы в серебре в твердом состоянии.
Серебро — стронций. Стронций в серебре нерастворим и образует с ним химические соединёния SrAg5, Sr2Ag5 (32,7 вес. %Sr), SrAg (44,82 вес. % Sr) и Sr3Ag2 (54,92 вес. % Sr).
Серебро — тантал. Взаимно нерастворимы.
Серебро — теллур. Образуют соединение Ag2Te. Система Аg — Ag2Te с ограниченной растворимостью в жидком состоянии: от 0 до 9 ат. % (10,4 вес. %) и от 31 ат. % (34,7 вес. %) до 37,16 вес. % теллура.
Серебро — сурьма (смотрите на рисунке ниже).
.jpg)
Серебро — таллий. Растворимость таллия в серебре в зависимости от температуры.
Серебро — тантал. Взаимно нерастворимы.
Серебро — теллур. Образуют соединение Ag2Te. Система Аg — Ag2Те с ограниченной растворимостью в жидком состоянии: от 0 до 9 ат. % (10,4 вес. %) и от 31 ат. % (34,7 вес. %) до 37,16 вес. % теллура (смотрите на рисунке ниже).
.jpg)
Серебро — торий. Растворимость тория в серебре равна примерно 0,1 ат. % (0,2 вес. %).
Серебро — уран. Ограниченная растворимость в жидком состоянии: от 100 до 97,4 ат. % (94,5 вес. %) и от 0,5 ат. % (0,23 вес. %) до 0 серебра при монотектической температуре, равной примерно 1132° С. Ж ↔ Аg + γ•U при 950°С и содержании 2,3 ат. % (5,0 вес. %). Растворимость урана в серебре при 950° С равна 0,19 ат. % (0,4 вес. %) урана.
Серебро — фосфор. Образуют два фосфида: АgР2 (36,48 вес. % Р) и AgP3 (46,28 вес. % Р). Растворимость фосфора в жидком серебре при температуре плавления равна приблизительно 1,45 вес. %, в твердом серебре 0,026 вес. % Р. Фосфид АйРг и серебро образуют при 0,97% Р эвтектику с температурой плавления 888°С.
Серебро — хром. Ограниченно растворимы в жидком состоянии при монотектической температуре (≈1445° С) и содержании 15 ат. % (8 вес. %) хро¬ма в серебре и 3,5 ат. % (7 вес. %) серебра в хроме. В твердом состоянии практически нерастворимы друг в друге.
Двойные системы сплавов
Золото — легирующий компонент
ЗОЛОТО — алюминий. Золото в алюминии практически нерастворимо (смотрите на рисунке ниже).
.jpg)
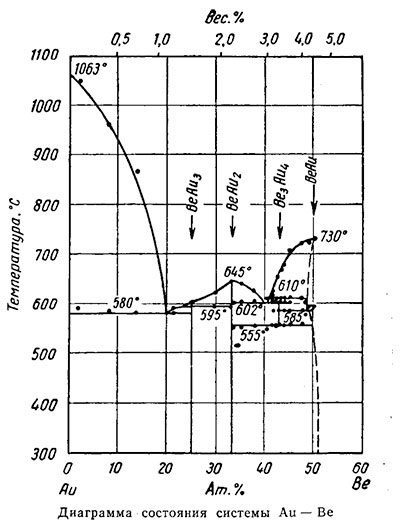
Золото — бериллий (смотрите на рисунке ниже).
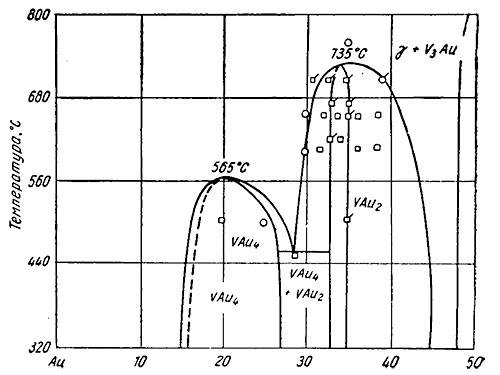
Золото — ванадий. Растворимость ванадия в золоте при 970° С равна примерно 17,5 ат. % (5,2 вес. %) и при 500° С 14 ат. % (4 вес. %) ванадия (смотрите на рисунке ниже).
Золото — висмут. Растворимость висмута в золоте равна 0,02% при 1040, 0,04 при 1000° С, 0,07 при 900° С, 0,03 при 800 и 700° С и менее 0,03 при 600 и 500° С. При дальнейшем уменьшении температуры растворимость практически отсутствует.
Золото — водород. Золото не соединяется с водородом с образованием гидридов. Водород не растворяется ни в твердом, ни в жидком золоте (до 1300° С).
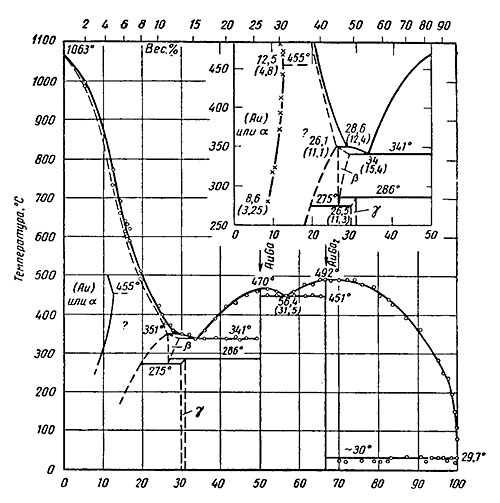
Золото — галлий. Растворимость галлия в золоте при 500° равна 11,15 ат. % (4,25 вес. %), при 455° С 12,5 ат. % (4,8 вес. %), при 400° С 11,8 ат. % (4,52 вес. %), при 350° С 10,9 ат. % (4,15 вес. %) при 300° С 9,4 ат. % (3,54 вес. %), при 270° С 8,1 ат. % (3,05 вес. %) (смотрите на рисунке ниже).
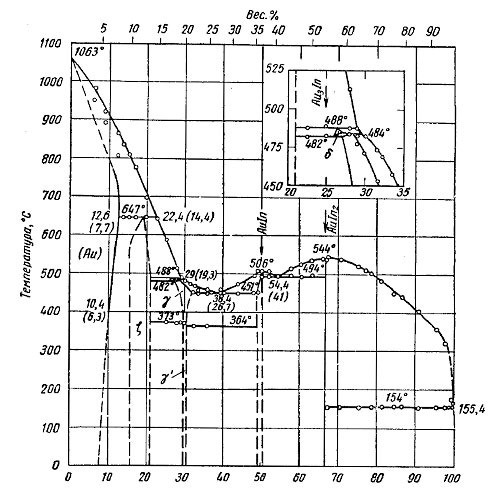
Золото — индий. Растворимость индия в золоте равна 11,3 ат. % (6,9 вес. %) при 767° С, 12,65 ат. % (7,8 вес. %) при 700° С, 12,57 ат. % (7,7 вес. %) при 650р С, 11,7 ат. % (7,1 вес. %) при 560° С, 10,96 ат. % (6,7 вес. %) при 482° С и 10,36 ат. % (6,3 вес. %) индия при 406° С (смотрите на рисунке ниже).
Золото — иридий. В жидком состоянии имеют разрыв растворимости от 2 до 99,9 вес. % золота.
Золото — кадмий (смотрите на рисунке ниже).
.jpg)
Золото—кальций. Растворимость кальция в золоте при 800° С менее 1,8 ат. % (0,3 вес. %) Са и золота в кальции при 658° С по расчету 4,5 ат. % (19 вес. %) Аu (смотрите на рисунке ниже).
.jpg)
Золото—кислород. В жидком состоянии кислород не растворяется в золоте.
Золото—кобальт. Образуют эвтектику при температуре 996° С, содержащую 27 ат. % (10 вес. %) кобальта. Доэвтектические сплавы имеют весьма узкий интервал кристаллизации. Растворимость кобальта в золоте при 996° С равна 23,5 ат. % (8,4 вес. %), при 800° С—8,1 ат. % (2,6 вес. %) , при 600° С 2,3 ат. % (0,7 вес. %), при 400° С 0,2 ат. % (0,1 вес. %) кобальта. У заэвтектических сплавов при 1122° С происходит магнитное превращение кобальта. Растворимость золота в кобальте при 1200° С — 2,5 ат. % (7,9 вес, %), при 996°С 1,9 ат. % (6,1 вес. %), при 900° С 1,4 ат. % (4,5 вес, %), при 700° С 0,5 ат. % (1,6 вес, %) , при 500° С 0,3 ат. % (1,0 вес. %) золота. При ~ 420° С β-Со ↔ α-Со.
Золото—магний. Растворимость магния в золоте равна ~ 3,5 вес %, золота при 576° С; в магнии 0,1 ат. % (0,8 вес. %) золота1 (смотрите на рисунке ниже).
.jpg)
Золото—марганец. Растворимость марганца в золоте при 960° С равна 30,8 ат. % (10,9 вес. %) Мп.
Золото—медь. Золото и медь в жидком состоянии взаимно растворимы в любых соотношениях (смотрите на рисунке ниже). При кристаллизации сплавы системы Аu — Сu образуют непрерывный ряд твердых растворов с точкой минимума при 82 вес. % золота и 884° С [37] и при 80 вес. % (56 ат. %) золота и 889° С [3].
Твердый раствор золото — медь имеет решетку гранецентрированного куба. Постоянная решетки изменяется в зависимости от состава аддитивно с незначительным положительным отклонением. При изучении системы Аu — Сu Н. С. Курнаковым и его сотрудниками была впервые установлена возможность упорядочения твердого раствора. С понижением температуры образовавшийся после затвердевания твердый раствор меди и золота претерпевает превращения. На кривых изменения свойств сплавов системы Аu — Сz в твердом состоянии обнаруживаются максимумы, которые соответствуют химическим соединениям Сu3Au (50,85 вес. % Аu) и СuАu (75,63 веса % Аu). Причиной этих реакций является тенденция к упорядочению расположения атомов с понижением температуры.
.jpg)
Процесс упорядочения с выделением фазы Курнакова СизАи происходит в интервале концентраций от 37,5 до 52,5% Сu. Область образования фазы Сu3Au ограничена на диаграмме кривой с максимумом при температуре, согласно большинству исследований 388 ± 3°. Упорядочение расположения атомов и переход к фазе Сu3Au происходит без изменения типа решетки: решетка куба с центрированными гранями сохраняется.
Процесс упорядочения с образованием соединения CuAu происходит в интервале концентраций от 15 до 32,5% Сu. Область образования ограничена на диаграмме кривой с максимумом при температуре, согласно большинству исследований, 415 ±10°С. Упорядочение расположения атомов сопровождается изменением типа и параметров решетки и выражается на рентгенограмме, помимо появления сверхструктурных линий, расщеплением части интерференционных линий твердого раствора. Определено, что упорядоченная фаза существует в двух модификациях: АuCuI и АuCuII. Модификация АuCuI, установленная ранее, имеет тетрагональную решетку. Структура АuCuII является орторомбической и тесно связана с тетрагональной структурой АиСиI.
Отмечается, что атомы меди и золота меняют свое положение в решетке в обратном порядке (так называемые антифазные домены), а на границах антифазных доменов имеются периодические дефекты. Можно считать, что структура АuCuII состоит из 10 расположенных рядом незначительно искаженных тетрагональных ячеек. Переход из АuCuII в АuCuI происходит в более узком интервале концентраций. Кривая, ограничивающая границы перехода из АuCuII в АuCuI, имеет максимум при температуре 385 ± 10° С. Фаза АuCuII обнаруживается при длительном отпуске сплавов, содержащих 36—47 и 53—65 ат. % Аu, при температуре 200—400° С.
На границе областей существования AuCuI и AuCuII предполагается существование двухфазной области AuCuI + AuCuII. В интервале диаграммы состояния между полями выделения Сu3Аu и СuАu образуется эвтектоид при 36—37 ат. % Аu и 285—300° С. В интервале концентраций 65— 80% ат. % в результате перитектической реакции образуется при 230—250° С химическое соединение СuА3. Максимум на кривой, ограничивающей область перехода из твердого раствора (Аu, Сu) в фазу СuАu3, повидимому, отсутствует. Фаза СuАu3 детально не изучена. Область твердого раствора отделена от областей существования фаз Курнакова двойными линиями, что указывает на температурный гистерезис превращений. На технологию сплавов золота, содержащих медь (двойные, тройные їй многокомпонентные), значительно влияет упорядочение в определенных интервалах концентрации. Вне этих интервалов сплавы Аu — Сu и Аu — Ag — Сu пластичны в горячем и холодном состоянии. Сплавы, в которых происходит упорядочение твердого раствора (Аu — Сu, Аu — Аg — Сu), необходимо отливать с высокой скоростью охлаждения (кристаллизации). Если упорядочение значительно ухудшает технологические характеристики (например, в области АuСu), обработке с целью повышения пластичности и снижения сопротивления деформации производят закалку.
При термической обработке сплавов Аu — Сu и Аu — Ag — Сu желательна нейтральная или слабовосстановительная атмосфера (смесь окиси и двуокиси углерода, диссоциированный и неполностью сожженный аммиак, азот, инертные газы, вакуум).
Золото — молибден. Ж ↔ (Аu) + (Мо) при 1054°С. Растворимость в золоте 1,25 ат. % .(0,61 вес. %) при 1054°С, 1,2 ат. % (0,59 вес. %) при 1000°С; 1,05—1,1 ат. % (0,52—0,54 вес. %) при 800° С, 0,9—0,95 ат. % (0,044—0,46 вес. %) при 600° С, 0,9 ат. % (0,44 вес. %) при 400° С и 0,7 ат. % (0,34 вес. %) молибдена при 200° С. Золото практически нерастворимо в молибдене.
Золото — натрий. Ж ↔ NаАu2 + Аu при 17,0 ат. % (2,3 вес. %) натрия и 876° С. Ж ↔ Na2A+ Na при 96,7 ат. % (77,5 вес. %) натрия и 82°С Натрий в золоте практически нерастворим.
Золото—никель (смотрите на рисунке ниже).
.jpg)
Система Аu — Ni: а — диаграмма состояния; б — твердость по Бринелю; 1 — магнитное превращение; 2 — закаленные при 900° С; 3 — отожженные
Золото—олово. Растворимость олова в золоте при 498° С равна 6,8 вес. % (4,2 ат. %); При 450° С 6,3 вес. % (3,9 ат. %), при 400° С 5,9 вес. % (3,6 ат. °/о), при 350° С 5,6 вес. % (3,5 ат. %) Sn, а золота в олове при 200° С 0,2 вес. % (0,3 ат. %).
Золото—осмий. Осмий в золоте практически нерастворим.
Золото—палладий. Образуют непрерывный ряд твердых растворов.
Золото—празеодим. Растворимость празеодима в золоте равна — 0,4 вес. % (0,55 ат. %) (смотрите на рисунке ниже).
.jpg)
Золото—ртуть. Растворимость ртути в золоте равна 17,3—19,3 ат. % (17,5—19,6 вес. %) при 400° С, 16,1—17,9 ат. % (16,3—18,2 вес. %) при 300° С, 15,6—'16,8 ат. % (15,8-17,0 вес. %) при 200° С и 15—17 ат. % ртути при 100°С. (смотрите на рисунке ниже).
.jpg)
Электрические свойства сплавов платины с золотом
| Свойства | Состояние сплава | Содержание Аu, ат. % (вес. %) | ||||||||||||||
| ρ25 мком • см | Отожженный Закаленный при |
600° С 800° С 900° С 1000° С |
18,41 19,16 20,95 18,69 19,35 |
19,26 24,20 24,38 23,35 27,02 |
19,14 16,58 22,39 26,27 35,70 |
22,76 23,98 19,44 29,76 33,49 |
19,26 23,16 25,08 26,62 36,93 |
20,84 25,01 26,61 27,76 36,75 |
25,70 29,68 29,02 32,23 45,23 |
25,25 27,56 29,35 31,28 44,02 |
23,53 26,54 27,84 30,45 47,08 |
25,22 35,04 36,71 38,99 45,62 |
26,61 30,77 31,01 30,18 33,39 |
21,58 23,79 25,11 25,68 28,13 |
12,90 18,73 21,07 20,54 20,90 |
|
| ρ100 мком • см | Отожженный Закаленный при |
600° С 800° С 900° С 1000° С |
21,29 22,14 24,19 21,71 22,56 |
22,17 26,95 27,29 26,00 29,91 |
21,89 18,46 24,87 29,05 38,38 |
25,41 26,41 21,19 32,35 35,58 |
21,34 25,34 27,31 28,80 39,08 |
23,05 27,12 28,80 29,63 37,46 |
26,68 31,99 29,33 36,48 47,56 |
26,84 29,02 30,72 32,42 44,78 |
24,88 27,46 28,88 31,79 48,04 |
26,48 36,17 37,72 40,13 46,29 |
27,55 31,48 31,94 31,04 34,31 |
22,41 24,42 26,00 26,12 28,95 |
13,63 19,57 22,12 21,54 21,92 |
|
| α × 1010 | Отожженный Закаленный при |
600° С 800° С 900° С 1000° С |
22,02 21,82 21,20 22,75 23,43 |
20,70 15,71 16,55 15,71 12,02 |
20,40 15,64 17,62 14,59 10,20 |
16,60 14,00 12,44 15,37 8,50 |
14,96 12,86 12,24 11,18 7,59 |
14,69 11,81 11,31 9,11 8,20 |
11,94 11,43 11,27 9,63 5,67 |
9,28 7,21 6,38 4,91 2,64 |
7,78 4,63 5,08 5,88 2,77 |
6,22 4,36 3,73 3,94 2,61 |
4,92 3,09 3,87 3,07 3,71 |
5,21 3,56 4,81 2,10 2,77 |
7,63 6,94 6,82 6,62 6,53 |
|
Золото—рутений. В жидком золоте растворяется ~ 1 вес. % Ru. При 1066° С происходит превращение Ж + β↔α и растворимость рутения ~ 1 вес. %, с понижением температуры она уменьшается.
Золото — свинец. Растворимость золота в свинце при 200° С равна 0,08 вес. % (0,076 ат. %) и при 170° С—0,03% золота.
Золото—сурьма. Растворимость сурьмы в золоте равна при 600° С 1,12 ат. % (0,7 вес. %), при 500° С 1,1 ат. % (0,68 вес. %), при 400° С 0,91 ат. % (0,56 вес. %), при 300° С 0,34 ат. % (0,21 вес. %) и при 200° С 0,0 ат. % сурьмы.
Золото—таллий. Растворимость таллия в золоте равна (смотрите на рисунке ниже):
Температура, °С 1040 1000 900 800 600 500 450 400 300 200
Растворимость, ат. % 0,48 0,75 0,79 0,90 0,82 0,71 0,51 0,35 0,21 0,17
.jpg)
Золото—теллур. Теллур в золоте практически нерастворим: около 0,01 вес. % теллура (смотрите на рисунке ниже). Содержание теллура в золоте и сплавах допустимо в количестве не более 0,01%, так как вызывает хрупкость при холодной и горячей деформации.
.jpg)
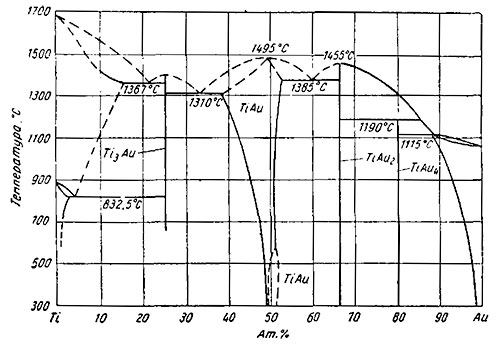
Золото — титан. Растворимость золота в β-Тi три 1000° С 5,0 ат. % (17,9 вес. %), в α-Тi при 830° С ~ 1,7 ат. % (6,6 вес. %) и при 600° С 0,7 ат. % (2,8 вес. %) золота (смотрите на рисунке ниже).
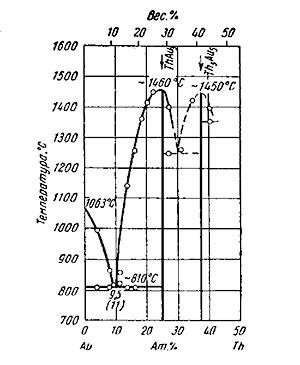
Золото—торий. Торий практически нерастворим в золоте (смотрите на рисунке ниже).
Золото — углерод. Расплавленное золото при значительном нагреве выше температуры плавления растворяет до 0,3% углерода. Карбид золота Аu2С2 очень неустойчив.
Золото—фосфор. Жидкое серебро поглотает пары фосфора. В твердом состоянии эти компоненты взаимно нерастворимы.
Золото — цирконий. Растворимость циркония в золоте равна при 1065° С 7,25 ат. % (8,5 вес. %), при 1000° С 7,1 ат. % (3,4 вес. %), при 900° С 6,1 ат. % (2,9 вес. %), при 800° С 4,4 ат. % (2,1 вес. %), при 700° С 3,0 ат. % (1,4 нес. %), при 600° С 1,75 ат. % (0,8 вес. %) и при 500° С 0,75 ат. % (0,85 вес. %) циркония.


